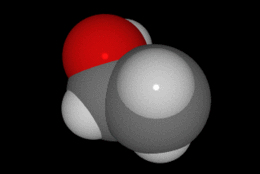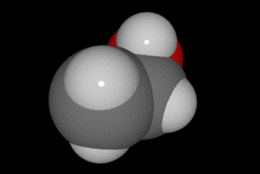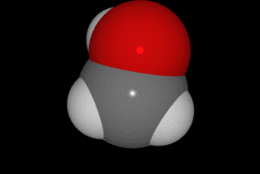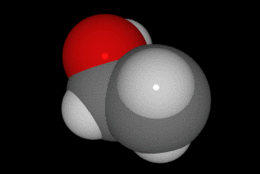
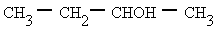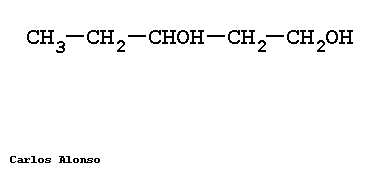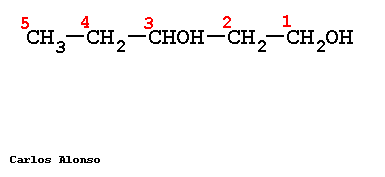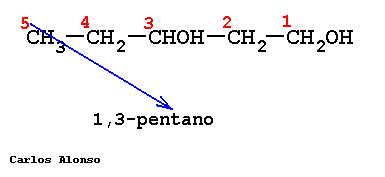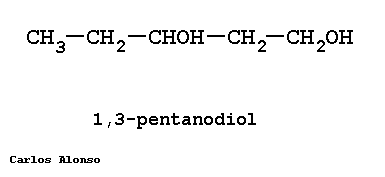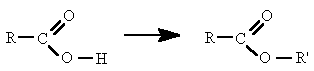En química se denomina alcohol (del árabe al-khwl الكحول, o al-ghawl الغول, "el espíritu", "toda sustancia pulverizada", "líquido destilado") (ver origen del término en la desambiguación) a aquellos hidrocarburos saturados, o alcanos que contienen un grupo hidroxilo (-OH) en sustitución de un átomo de hidrógeno enlazado de forma covalente.
Los alcoholes pueden ser primarios, secundarios o terciarios, en función del número de átomos de hidrógeno sustituidos en el átomo de carbono al que se encuentran enlazado el grupo hidroxilo.
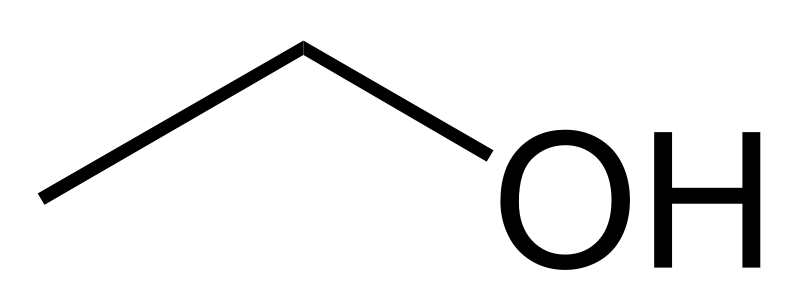
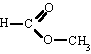
A nivel del lenguaje popular se utiliza para indicar comúnmente una bebida alcohólica, que presenta etanol, con formula química CH3CH2OH.
Si en la molécula hay más de un grupo -OH se utiliza la terminación "-diol", "-triol", etc., indicando con números las posiciones donde se encuentran esos grupos. Hay importantes polialcoholes como la glicerina "propanotriol", la glucosa y otros hidratos de carbono.
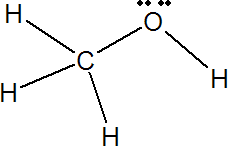
Grupo hidroxilo, característico de los alcoholes.
¿como se nombran?
Se nombran como los hidrocarburos de los que proceden, pero con la terminación "-ol", e indicando con un número localizador, el más bajo posible, la posición del grupo alcohólico. Según la posición del carbono que sustenta el grupo -OH, los alcoholes se denominan primarios, secundarios o terciarios.
2-butanol
1,2,3-propanotriol ou glicerina
Cuando el alcohol non es la función principal, se nombra como "hidroxi-", indicando el número localizador correspondiente.
3-hidroxi-4-metil-pentanal
hallar nombre
hallar formula
nomenclatura
Es común que los alcoholes se nombren usando la palabra alcohol como nombre, y con el "apellido" del grupo correspondiente a los alcanos básicos que le dan lugar, esta nomenclatura se ilustra a continuaciótipos y aplicaciones
Alcohol primario: los alcoholes primarios reaccionan muy lentamente. Como no pueden formar carbocationes, el alcohol primario activado permanece en solución hasta que es atacado por el ión cloruro. Con un alcohol primario, la reacción puede tomar desde treinta minutos hasta varios días.
Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 20 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
Alcohol terciario: los alcoholes terciarios reaccionan casi instantáneamente, porque forman carbocationes terciarios relativamente estables.
el alcohol etílico uso consumo humano y el único. usos : whisky aguardiente entre otros
uso en exceso perjudicial
, el industrial,
Butílico no apto para consumo solvente 120 grados 250% toxicidad !! no apto anda chico! es industrial !!!
metílico metanol no apto puede causar ceguera 20% toxicidad
Isopropílico antiséptico toxico 90 grados 40% toxicidad
Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 20 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
Alcohol terciario: los alcoholes terciarios reaccionan casi instantáneamente, porque forman carbocationes terciarios relativamente estables.
el alcohol etílico uso consumo humano y el único. usos : whisky aguardiente entre otros
uso en exceso perjudicial
, el industrial,
Butílico no apto para consumo solvente 120 grados 250% toxicidad !! no apto anda chico! es industrial !!!
metílico metanol no apto puede causar ceguera 20% toxicidad
Isopropílico antiséptico toxico 90 grados 40% toxicidad
etanol
(alcohol etilico)
El compuesto químico etanol, conocido como alcohol etílico, es un alcohol que se presenta como un líquido incoloro e inflamable con un punto de ebullición de 78 °C.Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Su fórmula química es CH3-CH2-OH, principal producto de las bebidas alcohólicas como el vino (alrededor de un 13%), la cerveza (5%) o licores (hasta un 50%).
Dependiendo del género de bebida alcohólica que lo contenga, el etanol aparece acompañado de distintos elementos químicos que lo dotan de color, sabor, olor, entre otras características.
Destilación
Para obtener etanol libre de agua se aplica la destilación azeotrópica en una mezcla con benceno o ciclohexano. De estas mezclas se destila a temperaturas más bajas el azeótropo, formado por el disolvente auxiliar con el agua, mientras que el etanol se queda retenido. Otro método de purificación muy utilizado actualmente es la absorción física mediante tamices moleculares. A escala de laboratorio también se pueden utilizar desecantes como el magnesio, que reacciona con el agua formando hidrógeno y óxido de magnesio.aplicaciones
Es un buen disolvente, y puede utilizarse como anticongelante. También es un desinfectante. Su mayor potencial bactericida se obtiene a una concentración de aproximadamente el 70%.
Industria química
La industria química lo utiliza como compuesto de partida en la síntesis de diversos productos, como el acetato de etilo (un disolvente para pegamentos, pinturas, etc.), el éter dietílico, etc.También se aprovechan sus propiedades desinfectantes.
Combustible
Se emplea como combustible industrial y doméstico. En el uso doméstico, se emplea el alcohol de quemar. Éste además contiene compuestos como la pirovidos exclusivamente a alcohol. Este país es uno de los principales productores (con 18 mil millones de litros anuales), con esto reducen un 40% de sus importaciones de crudo. Esta última aplicación se extiende también cada vez más en otros países para cumplir con el protocolo de Kyoto. Estudios del Departamento de Energía de USA dicen que el uso en automóviles reduce la producción de gases de invernadero en un 85%.[cita requerida] En países como México existe la política del ejecutivo federal de apoyar los proyectos para la producción integral de etanol y reducir la importación de gasolinas que ya alcanza el 60%.metanol
También llamado Metanol, es un líquido incoloro y móvil, de olor característico a alcohol, es muy venenoso, mantener las medidas de seguridad correspondientes para su manipulación.
Se utiliza principalmente como deshidratante por sus características higroscópicas y por su rápida evaporación. También se lo utiliza en el proceso de transesterificación, para la producción del Bio-Diesel.
Se presenta puro al 99,90 % anhidro, y desnaturalizado, al 97 % con un 3 % de alcohol isopropílico, o bien al 99,8 % desnaturalizado con colorante y/o un amargante que provoca el vómito, para evitar su ingestión accidental (ver últimas regulaciones del I.N.V.)
aplicaciones
I
_intermediario en elaboracion de formol_disolvente industrial